 |
|
Главная :: Архив статей :: Поиск :: :: Ссылки |
 |
|
Главная :: Архив статей :: Поиск :: :: Ссылки |
Архив статей > Химия > Теллур
Теллур
Т. И. Молдавер
Химия и Жизнь №3, 1972 г., с. 17-21
"КРЕСТНИК ЗЕМЛИ"
Вряд ли кто-либо поверит рассказу о нашем современнике - капитане дальнего плавания, который, кроме того, профессиональный цирковой борец, известный металлург и врач-консультант хирургической клиники. В мире же химических элементов подобное разнообразие профессий - вещь, весьма распространенная. Вспомним (еще до разговора о главном объекте нашего рассказа) железо в машинах и железо в крови, железо- концентратор магнитного поля, и железо - составную часть охры... Правда, на "профессиональную выучку" элементов порой уходило намного больше времени, чем на подготовку йога средней квалификации. Так и элемент № 52, о котором предстоит нам рассказать, долгие годы применяли лишь для того, чтобы продемонстрировать, каков он в действительности, этот элемент, названный в честь нашей планеты: теллур - от tellus, что по-латыни значит "Земля".
Элемент № 52 открыт почти два века назад. В 1782 году горный инспектор Франц Иозеф Мюллер фон Рейхенштейн исследовал золотоносную руду, найденную в Семигорье, на территории тогдашней Австро-Венгрии. Расшифровать состав этого минерала оказалось настолько сложно, что его назвали Aurum problematicum - "золото проблематичное". Именно из него Мюллер выделил новый металл. Но полной уверенности в том, что этот металл действительно новый, не было. (Впоследствии оказалось, что Мюллер ошибался в другом: открытый им элемент был-таки новым, но к числу металлов отнести его можно с большой натяжкой.) Чтобы рассеять сомнения, Мюллер обратился за помощью к видному специалисту, шведскому минералогу и аналитику Т. Бергману. Но тот умер, не успев закончить анализ присланного вещества,- в те годы аналитические методы были уже довольно точными, но анализ занимал очень много времени.
В элементе, открытом Мюллером, пытались разобраться и другие ученые, но лишь через 16 лет после открытия Мартин Генрих Клапрот - один из крупнейших химиков того времени - неопровержимо доказал, что теллур - действительно новый элемент. Кстати, название "теллур" предложил именно Клапрот.
ТЕЛЛУР И МЕДИКИ
Понятно, что вслед за открытием элемента всегда начинаются поиски возможных его применений. Видимо, исходя из старого - еще времен иатрохимии - принципа, что мир - это аптека, француз Фурнье пробовал лечить теллуром некоторые тяжелые заболевания, проказу в частности. Но без успеха. Лишь спустя много лет теллур смог оказать медикам некоторые услуги. Точнее, не сам теллур, а соли теллуристой кислоты - К2ТеО3 и Na2TeO3. Их стали использовать в микробиологии как красители, придающие определенный цвет изучаемым бактериям. В частности, с помощью соединений теллура надежно выделяют из массы бактерий дифтерийную палочку. Если не в лечении, так хоть в диагностике элемент № 52 оказался полезен врачам.
Но иногда этот элемент, а в еще большей мере некоторые его соединения прибавляют врачам хлопот. Теллур достаточно токсичен. В нашей стране принята предельно допустимая концентрация теллура в воздухе 0,01 мг/м3. Из соединений теллура самое опасное - теллуроводород Н2Те, бесцветный ядовитый газ с неприятным запахом. Последнее вполне естественно: теллур - аналог серы, значит, Н2Те должен быть подобен сероводороду. Он раздражает бронхи, вредно влияет на нервную систему.
Эти неприятные свойства не помешали теллуру выйти в технику.
ТЕЛЛУР В ТЕХНИКЕ
Металлурги интересуются теллуром потому, что уже небольшие его добавки к свинцу сильно повышают прочность и химическую стойкость этого важного металла. Свинец, легированный теллуром, применяют в кабельной и химической промышленности; срок службы аппаратов сернокислотного производства, покрытых изнутри свинцово-теллуровым сплавом (0,5% Те), вдвое больше, чем у таких же аппаратов, облицованных просто свинцом. Присадка теллура к меди и стали облегчает их механическую обработку.
В стекольном производстве теллуром пользуются, чтобы придать стеклу коричневую окраску и больший коэффициент лучепреломления. В резиновой промышленности его, как аналог серы, иногда применяют для вулканизации каучуков. Однако не эти отрасли были виновниками скачка в ценах и спросе на элемент № 52.
Произошел этот скачок в начале шестидесятых годов нашего века. Теллур - типичный полупроводник, и полупроводник технологичный. В отличие от германия и кремния, он сравнительно легко плавится (температура плавления 449,8°С) и испаряется (закипает при температуре чуть ниже 1000°С). Из него легко получать тонкие полупроводниковые пленки, которыми интересуется современная микроэлектроника...
Однако чистый теллур как полупроводник применяют ограниченно - для изготовления транзисторов некоторых типов и в приборах, которыми измеряют интенсивность гамма-излучения. Иногда примесь теллура вводят в арсенид галлия (третий по значению после кремния и германия полупроводник), чтобы создать в нем проводимость электронного типа.
Намного обширнее области применения некоторых теллуридов - соединений теллура с металлами. Теллуриды висмута Вi2Те3 и сурьмы Sb2Те3 стали самыми важными материалами для термоэлектрических генераторов. Чтобы объяснить, почему это произошло и что такое термоэлектрогенераторы, сделаем небольшое отступление в область физики и истории.
ТРИ ЭФФЕКТА
Еще полтора века назад (в 1821 году) немецкий физик Т. Зеебек обнаружил, что в замкнутой электрической цепи, состоящей из разных материалов, создается электродвижущая сила, если места контактов находятся при разных температурах.
Через двенадцать лет швейцарец Ж. Пельтье обнаружил эффект, обратный явлению Зеебека: когда электрический ток течет по цепи, составленной из разных материалов, в местах контактов кроме обычной джоулевой теплоты выделяется или поглощается (в зависимости от направления тока) некоторое количество тепла. То, что при этом имеет место не нарушение закона Джоуля, но новый физический эффект, доказал Э. X. Ленц.
Примерно сто лет эти открытия оставались любопытными фактами, не более. И не будет преувеличением утверждать, что новая жизнь обоих этих эффектов началась после того, как академик А. Ф. Иоффе с сотрудниками разработал теорию применения полупроводниковых материалов для изготовления термоэлементов. А вскоре эта теория воплотилась в реальные термоэлектрогенераторы и термоэлектрохолодильники различного назначения.
В частности, термоэлектрогенераторы, в которых использованы теллуриды висмута, свинца и сурьмы, дают энергию искусственным спутникам Земли, навигационно-метеорологическим установкам, устройствам катодной защиты магистральных трубопроводов. Те же материалы помогают поддержать нужную температуру во многих электронных и микроэлектронных устройствах.
В последние годы большой интерес вызывает еще одно химическое соединение теллура, обладающее полупроводниковыми свойствами,- теллурид кадмия CdTe. Этот материал используют для изготовления солнечных батарей, лазеров, фотосопротивлений, счетчиков радиоактивных излучений. Теллурид кадмия знаменит и тем, что это один из немногих полупроводников, в которых проявляется эффект Гана.
Суть последнего заключается в том, что введение маленькой пластинки соответствующего полупроводника в достаточно сильное электрическое поле приводит к генерации высокочастотного радиоизлучения. Эффект Гана уже нашел применение в радиолокационной технике.
ДОБЫЧА ТЕЛЛУРА
Теллур находится в главной подгруппе VI группы таблицы Менделеева, вместе с серой и селеном. Эти три элемента сходны по химическим свойствам и часто сопутствуют друг другу в природе. Но доля серы в земной коре - 0,03%, селена - 10-5%, теллура же еще меньше - 10-7%. Естественно, что теллур, как и селен, чаще всего встречается в природных соединениях серы - как примесь. Бывает, правда (вспомните о минерале, в котором открыли теллур), что этот элемент в природе образует соединения с золотом, серебром, медью и другими элементами. На нашей планете открыто более ПО месторождений сорока минералов теллура. Но добывают его всегда заодно с селеном, или золотом, или другими металлами.
В СССР известны медно-никелевые теллурсодержащие руды Печенги и Мончегорска, теллурсодержащие свинцово-цинковые рудь" Алтая и другие месторождения.
При выделении из медной руды теллур получают на стадии очистки черновой меди электролизом. На дно электролизера выпадает осадок - шлам. Это очень дорогой полупродукт. Приведем для иллюстрации состав шлама одного из канадских заводов: 49,8% меди, 1,976% золота, 10,52% серебра, 28,42% селена и 3,83% теллура.
Но ценнейшие компоненты шлама надо разделить. Существует несколько вариантов решения этой задачи. Вот один из них.
Шлам расплавляют в печи и через расплав пропускают воздух. Металлы, кроме золота и серебра, окисляются, переходят в шлак. Селен и теллур тоже окисляются, но их окислы летучие; их улавливают в специальных аппаратах (скруберах), затем растворяют и превращают в кислоты - селенистую H2SeO3 и теллуристую Н2ТеО3. Если через этот раствор пропустить сернистый газ SO2, произойдут такие реакции:
H2SeO3 + 2SO2 + Н2О = Se + 2H2SO4,
Н2ТеO3 + 2SO2 + Н2O = Те + 2H2SO4.
Но ведь совсем не нужно, чтобы теллур и селен выпадали одновременно: они нужны нам порознь.
Поэтому условия процесса подбирают таким образом, чтобы, в соответствии с законами химической термодинамики, сначала восстанавливался преимущественно селен. Этому помогает подбор оптимальной концентрации добавляемой в раствор соляной кислоты.
Затем осаждают теллур. Выпавший серый порошок содержит некоторое количество селена и, кроме того, серу, свинец, медь, натрий, кремний, алюминий, железо, олово, сурьму, висмут, серебро, магний, золото, мышьяк, хлор. И теллур приходится чистить - сначала химическими методами, затем перегонкой или зонной плавкой.
Из других руд теллур извлекают, разумеется, иначе.
ПРОМЫШЛЕННЫЙ ЯД
Теллур применяют все шире. Значит, возрастает и число работающих с ним. Во второй главе нашего рассказа об элементе № 52 мы уже упоминали о токсичности теллура и его соединений. Расскажем об этом подробней - именно потому, что с теллуром приходится работать все большему числу людей. Цитирую диссертацию, защищенную в 1962 году и посвященную теллуру как промышленному яду. Белые крысы, которым ввели аэрозоль теллура, "проявляли беспокойство, чихали, терли мордочки, делались вялыми и сонливыми". Подобным образом действует теллур и на людей.
И сам теллур, и его соединения могут приносить беды разных калибров. Они, например, вызывают облысение, влияют на кровь, могут блокировать различные ферментные системы. Симптомы хронического отравления элементарным теллуром - тошнота, сонливость, исхудание; выдыхаемый воздух приобретает скверный чесночный запах алкилтеллуридов.
При острых отравлениях теллуром вводят внутривенно сыворотку с глюкозой, а иногда даже морфий. Как профилактическое средство употребляют аскорбиновую кислоту. Но главная профилактика- это надежная герметизация аппаратов, автоматизация процессов, в которых участвуют теллур и его соединения.
Элемент № 52 приносит много пользы и уже потому заслуживает внимания. Но одновременно он требует осторожности, четкости в работе к опять-таки - внимания.
Что вы знаете и чего не знаете о теллуре и его соединениях
КАК ВЫГЛЯДИТ ТЕЛЛУР
Кристаллический теллур больше всего похож на сурьму. Цвет его - серебристо-белый. Кристаллы - гексагональные, атомы в них образуют спиральные цепи и связаны ковалентными связями с ближайшими соседями. Поэтому элементарный теллур можно считать неорганическим полимером. Кристаллическому теллуру свойствен металлический блеск, хотя по комплексу химических свойств его скорее можно отнести к неметаллам. Теллур хрупок, его довольно просто превратить в порошок. Вопрос о существовании аморфной модификации теллура однозначно не решен. При восстановлении теллура из теллуристой или теллуровой кислот выпадает осадок, однако до сих пор не ясно, являются ли эти частички истинно аморфными или это просто очень мелкие кристаллы.
ДВУХЦВЕТНЫЙ АНГИДРИД
Как и положено аналогу серы, теллур проявляет валентности 2-, 4+ и 6+ и значительно реже 2+. Моноокись теллура ТеО может существовать лишь в газообразном виде и легко окисляется до ТеО2. Это белое негигроскопичное, вполне устойчивое кристаллическое вещество, плавящееся без разложения при 733°С, полимер, молекула которого построена так:
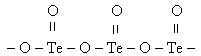
В воде двуокись теллура почти не растворяется: в раствор переходит лишь одна часть ТеО2 на полтора миллиона частей воды. Получается очень разбавленный раствор слабой тел-луристой кислоты H2ТеО3. Слабо выражены кислотные свойства и у теллуровой кислоты Н6ТеО6. Такую формулу (а не Н2ТеО4,)) ей присвоили после того, как были получены соли состава Ag6TeO6 и Hg3TeO6. В воде она растворяется хорошо. А вот образующий ее теллуровый ангидрид ТеО3 в воде практически не растворяется. Это вещество существует в двух модификациях - желтого и серого цвета: альфа-ТеО3 и бета-ТеО3. На серый теллуровый ангидрид даже при нагревании не действуют кислоты и концентрированные щелочи. От желтой разновидности его очищают, кипятя смесь в концентрированном растворе КОН.
ВТОРОЕ ИСКЛЮЧЕНИЕ
Когда создавалась таблица Менделеева, теллур и его сосед йод (так же, как впоследствии аргон и калий) были поставлены на свои места в VI и VII группы не в соответствии, а вопреки атомным весам. Действительно, атомный вес теллура-127,61, а йода-126,91. Значит, йод должен был бы стоять не за теллуром, а впереди него. Менделеев, однако, не колеблясь, поместил йод в седьмую группу, а теллур в шестую. Он считал, что атомные веса определены недостаточно точно. Друг Менделеева чешский химик Богуслав Браунер тщательно проверил величины атомных весов этих элементов, но его данные совпали с прежними. Правомерность исключений, подтверждающих правило, была установлена, когда в основу периодической системы легли не атомные веса, а заряды ядер и когда стал известен изотопный состав обоих элементов. У теллура, в отличие от йода, преобладают тяжелые изотопы.
Кстати, об изотопах. Сейчас известны 22 изотопа элемента № 52. Стабильных из них восемь- с массовыми числами 120, 122, 123, 124, 125, 126, 128 и 130. Последние два -самые распространенные: их доли 31,79 и 34,48% соответственно.
МИНЕРАЛЫ ТЕЛЛУРА
Хотя теллура на Земле значительно меньше, чем селена, известно больше минералов теллура, чем этого его аналога. По составу они двояки: или теллуриды, или продукты окисления теллуридов в земной коре. Среди первых калаверит АuТe2 и креннерит (Au, Ag)Te2. Они входят в число немногих природных соединений золота. Известны также природные теллуриды висмута, свинца, ртути. Очень редко в природе встречается и самородный теллур. Еще до открытия этого элемента его иногда находили в сульфидных рудах, но не могли правильно идентифицировать. Практического значения минералы теллура не имеют - весь промышленный теллур получают попутно.
|
|
Главная :: Архив статей :: Поиск :: :: Ссылки